0 引言
1 地质背景
2 样品和实验
2.1 样品的选取
2.2 实验方法与过程
3 实验结果
3.1 有机质丰度
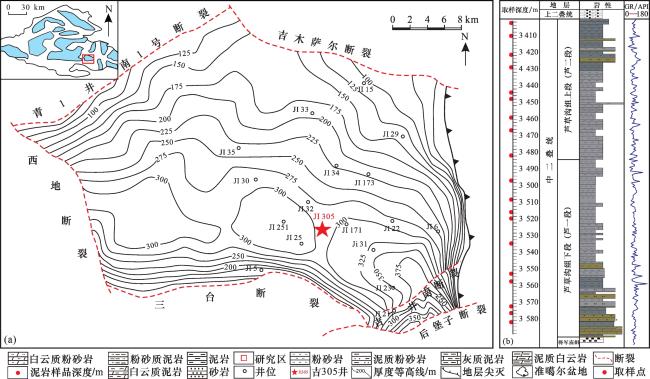
图2 吉木萨尔凹陷J305井芦草组烃源岩典型生物标志物谱图(a)—(e)为典型样品的m/z=85质谱图;(f)-(j)为典型样品的m/z=191质谱图;(k)-(o)为典型样品的m/z=217质谱图 Fig.2 Typical biomarker spectrum of source rocks in Lucaogou Formation of Well J305 in Jimusar Sag |
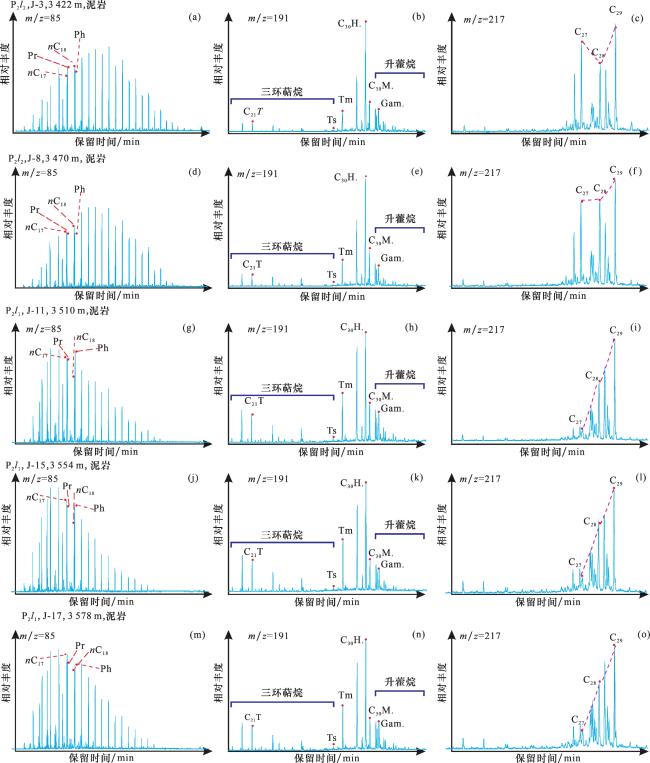
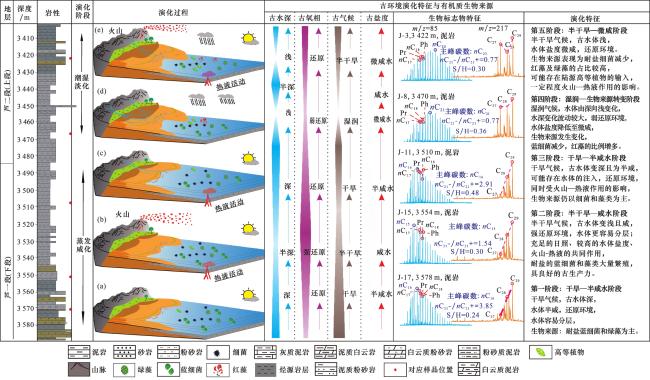
图3 准噶尔盆地吉木萨尔凹陷J305井芦草沟组古环境地球化学参数纵向变化TOC=总有机碳(%);Pr/Ph=姥鲛烷/植烷;ETR=(C28+C29)/(C28+C29+Ts);S/H=甾烷/藿烷;C21-/C22+=短链正构烷烃( )/长链正构烷烃( );G/H=伽马蜡烷/C30藿烷;27%=C27甾烷/(C27甾烷+C28甾烷+C29甾烷);28%=C28甾烷/(C27甾烷+C28甾+C2甾烷);29%=C29甾烷/(C27甾烷+C28甾烷+C29甾烷);(7-+8-MMAs)/Cmax=(7-+8-C18单甲基烷烃)/最大正构烷烃(%);2α-C32Meh/C32H=2α-C32甲基藿烷/C32藿烷(%);古气候指数C=(Fe+Mn+Cr+V+Co+Ni)/(Ca+Mg+Sr+Ba+K+Na) Fig.3 Vertical variation diagram of paleoenvironmental geochemical parameters of Lucaogou Formation in Well J305 of Jimusar Sag, Junggar Basin |
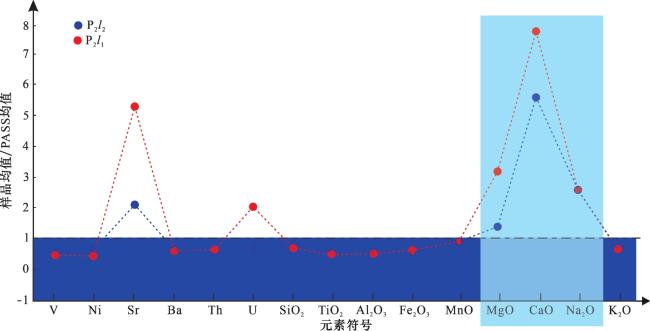
3.2 主量元素和微量元素
表1 J305井芦草沟组芦一段和芦二段主量、微量元素含量Table 1 Major and trace element content of the upper and lower members of Lucaogou Formation in Well J305 |
| 层位 | 范围 | TOC /% | w(微量元素)/10-6 | w(主量元素)/% | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| V | Ni | Sr | Ba | Th | U | SiO2 | TiO2 | Al2O3 | Fe2O3 | MnO | MgO | CaO | Na2O | K2O | ||||
| P2 l 2 | 最大值 | 13.46 | 111 | 60 | 871 | 628 | 23 | 4 | 59.4 | 0.7 | 14.5 | 6 | 0.2 | 6.2 | 11 | 4.5 | 2.9 | |
| 最小值 | 2.83 | 60 | 19 | 82 | 253 | 3 | 1 | 40 | 0.4 | 8 | 1.7 | 0.1 | 1.5 | 0.8 | 1.1 | 1.1 | ||
| 平均值 | 5.79 | 85 | 34 | 422 | 414 | 8 | 2 | 50.9 | 0.5 | 10.5 | 3.8 | 0.1 | 3 | 7.3 | 3.1 | 2.1 | ||
| P2 l 1 | 最大值 | 10.31 | 97 | 35 | 7 454 | 650 | 45 | 55 | 52.3 | 0.5 | 10.8 | 4.9 | 0.1 | 8.7 | 13.8 | 4.1 | 3.6 | |
| 最小值 | 2.63 | 48 | 10 | 288 | 289 | 3 | 1 | 38.3 | 0.3 | 5.3 | 2.8 | 0.1 | 4.3 | 5.6 | 1.7 | 1.5 | ||
| 平均值 | 6.33 | 69 | 23 | 1 053 | 412 | 9 | 6 | 42.9 | 0.4 | 8.3 | 3.9 | 0.1 | 6.8 | 10 | 3.1 | 2.2 | ||
| PAAS 平均值 | — | 150 | 55 | 200 | 650 | 15 | 3 | 62.8 | 0.99 | 18.9 | 7.18 | 0.11 | 2.19 | 1.29 | 1.19 | 3.68 | ||
|
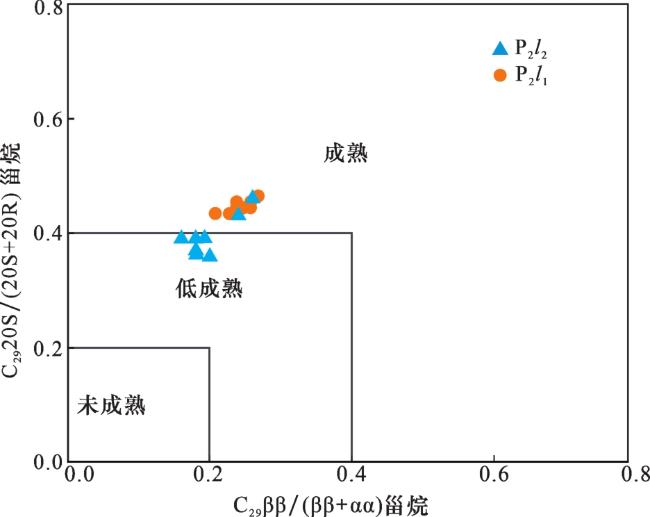
3.3 生物标志物
表2 准噶尔盆地吉木萨尔凹陷J305井芦草沟组烃源岩样品生物标志物参数Table 2 Biomarker compound parameters of source rock samples from Lucaogou Formation in Well J305 of Jimusar Sag, Junggar Basin |
| 地层 | 样品编号 | 深度/m | 岩性 | TOC/% | G/H | TAR | 20S | ββ | (7-+8-C18MMAs)/Cmax | 2α-C32Meh/C32H | ETR |
|---|---|---|---|---|---|---|---|---|---|---|---|
| P2 l 2 | J-1 | 3 402 | 泥岩 | 6.02 | 0.16 | 0.33 | 0.39 | 0.19 | 9.29% | 5.17% | 0.57 |
| J-2 | 3 410 | 泥岩 | 7.30 | 0.17 | 0.29 | 0.39 | 0.18 | 9.53% | 5.01% | 0.47 | |
| J-3 | 3 422 | 泥岩 | 4.36 | 0.19 | 0.71 | 0.36 | 0.18 | 6.32% | 4.95% | 0.65 | |
| J-4 | 3 430 | 泥岩 | 5.02 | 0.20 | 0.26 | 0.37 | 0.18 | 8.88% | 4.25% | 0.58 | |
| J-5 | 3 446 | 泥岩 | 5.50 | 0.25 | 0.07 | 0.46 | 0.26 | 9.42% | 4.42% | 0.52 | |
| J-6 | 3 450 | 泥岩 | 5.94 | 0.22 | 1.08 | 0.36 | 0.20 | 3.55% | 5.33% | 0.75 | |
| J-7 | 3 462 | 泥岩 | 3.70 | 0.35 | 0.41 | 0.39 | 0.16 | 7.16% | 5.32% | 0.74 | |
| J-8 | 3 470 | 泥岩 | 2.83 | 0.22 | 0.67 | 0.37 | 0.18 | 8.09% | 5.34% | 0.66 | |
| J-9 | 3 486 | 泥岩 | 3.45 | 0.18 | 0.44 | 0.43 | 0.24 | 11.60% | 5.72% | 0.89 | |
| 芦二段平均值 | 4.90 | 0.22 | 0.47 | 0.39 | 0.20 | 8.20% | 5.06% | 0.65 | |||
| P2 l 1 | J-10 | 3 498 | 泥岩 | 6.08 | 0.24 | 0.15 | 0.43 | 0.21 | 17.78% | 5.96% | 0.87 |
| J-11 | 3 510 | 泥岩 | 2.66 | 0.30 | 0.13 | 0.43 | 0.23 | 18.04% | 7.30% | 0.80 | |
| J-12 | 3 518 | 泥岩 | 7.55 | 0.18 | 0.12 | 0.43 | 0.21 | 15.82% | 5.63% | 0.88 | |
| J-13 | 3 522 | 泥岩 | 3.30 | 0.22 | 0.71 | 0.44 | 0.25 | 13.65% | 5.68% | 0.93 | |
| J-14 | 3 538 | 泥岩 | 3.19 | 0.26 | 0.75 | 0.45 | 0.24 | 17.66% | 5.67% | 0.87 | |
| J-15 | 3 554 | 泥岩 | 6.20 | 0.25 | 0.06 | 0.44 | 0.24 | 14.64% | 6.92% | 0.80 | |
| J-16 | 3 562 | 泥岩 | 7.58 | 0.26 | 0.10 | 0.45 | 0.26 | 16.21% | 6.25% | 0.72 | |
| J-17 | 3 578 | 泥岩 | 9.21 | 0.26 | 0.10 | 0.44 | 0.26 | 15.00% | 6.39% | 0.70 | |
| J-18 | 3 582 | 泥岩 | 5.15 | 0.21 | 0.58 | 0.44 | 0.26 | 14.89% | 6.05% | 0.75 | |
| J-19 | 3 586 | 泥岩 | 8.30 | 0.23 | 0.53 | 0.46 | 0.27 | 16.36% | 6.48% | 0.79 | |
| 芦一段平均值 | 5.92 | 0.24 | 0.32 | 0.44 | 0.24 | 16.01% | 6.23% | 0.81 | |||
|
4 讨论
4.1 沉积古环境
4.1.1 元素分布差异
4.1.2 古水深
表3 准噶尔盆地吉木萨尔凹陷J305井芦草沟组烃源岩样品元素地球化学参数Table 3 Element geochemical parameters of source rock samples from Lucaogou Formation in Well J305, Jimusar Sag, Junggar Basin |
| 地层 | 样品编号 | 深度/m | 岩性 | TOC/% | V/(V+Ni) | Sr/Cu | Rb/Sr | Sr/Ba | Ti/Mn | Fe/Mn | 古气候指数C | Al/(Al+Fe+Mn) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P2 l 2 | J-1 | 3 402 | 泥岩 | 6.02 | 0.73 | 6.92 | 0.26 | 0.67 | 5.10 | 22.50 | 0.15 | 0.76 |
| J-2 | 3 410 | 泥岩 | 7.30 | 0.68 | 14.35 | 0.14 | 0.92 | 4.02 | 19.64 | 0.12 | 0.78 | |
| J-3 | 3 422 | 泥岩 | 4.36 | 0.75 | 15.53 | 0.16 | 1.04 | 12.17 | 60.32 | 0.20 | 0.75 | |
| J-4 | 3 430 | 泥岩 | 5.02 | 0.73 | 6.51 | 0.21 | 0.96 | 2.75 | 30.60 | 0.31 | 0.38 | |
| J-5 | 3 446 | 泥岩 | 5.50 | 0.77 | 5.56 | 0.31 | 0.65 | 3.30 | 27.30 | 0.21 | 0.70 | |
| J-6 | 3 450 | 泥岩 | 5.94 | 0.78 | 31.06 | 0.07 | 2.08 | 3.88 | 24.08 | 0.13 | 0.74 | |
| J-7 | 3 462 | 泥岩 | 3.70 | 0.60 | 2.81 | 0.62 | 0.19 | 11.13 | 120.61 | 0.58 | 0.64 | |
| J-8 | 3 470 | 泥岩 | 2.83 | 0.66 | 4.41 | 0.23 | 0.59 | 2.13 | 30.30 | 0.26 | 0.32 | |
| J-9 | 3 486 | 泥岩 | 3.45 | 0.75 | 22.11 | 0.24 | 1.15 | 2.87 | 30.10 | 0.26 | 0.55 | |
| 芦二段平均值 | 4.90 | 0.72 | 12.14 | 0.25 | 0.92 | 5.26 | 40.60 | 0.25 | 0.63 | |||
| P2 l 1 | J-10 | 3 498 | 泥岩 | 6.08 | 0.78 | 19.69 | 0.11 | 1.60 | 3.73 | 34.11 | 0.24 | 0.59 |
| J-11 | 3 510 | 泥岩 | 2.66 | 0.78 | 42.12 | 0.34 | 1.71 | 2.02 | 32.80 | 0.17 | 0.64 | |
| J-12 | 3 518 | 泥岩 | 7.55 | 0.72 | 65.00 | 0.01 | 11.46 | 2.10 | 29.71 | 0.20 | 0.28 | |
| J-13 | 3 522 | 泥岩 | 3.30 | 0.79 | 65.29 | 0.06 | 1.45 | 3.40 | 32.21 | 0.20 | 0.30 | |
| J-14 | 3 538 | 泥岩 | 3.19 | 0.72 | 46.35 | 0.09 | 1.43 | 4.07 | 44.60 | 0.26 | 0.64 | |
| J-15 | 3 554 | 泥岩 | 6.20 | 0.73 | 17.66 | 0.11 | 2.15 | 3.30 | 35.60 | 0.22 | 0.66 | |
| J-16 | 3 562 | 泥岩 | 7.58 | 0.80 | 22.79 | 0.08 | 2.20 | 2.65 | 29.20 | 0.14 | 0.35 | |
| J-17 | 3 578 | 泥岩 | 9.21 | 0.75 | 9.89 | 0.13 | 1.42 | 2.20 | 24.81 | 0.16 | 0.60 | |
| J-18 | 3 582 | 泥岩 | 5.15 | 0.78 | 23.95 | 0.11 | 1.52 | 2.00 | 23.50 | 0.14 | 0.59 | |
| J-19 | 3 586 | 泥岩 | 8.30 | 0.86 | 26.53 | 0.07 | 1.98 | 1.69 | 22.61 | 0.12 | 0.57 | |
| 芦一段平均值 | 5.92 | 0.77 | 33.93 | 0.11 | 2.69 | 2.72 | 30.91 | 0.18 | 0.52 | |||
|


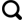
 甘公网安备 62010202000678号
甘公网安备 62010202000678号