0 引言
1 煤的超临界等温吸附实验
1.1 实验样品
表1 煤样基本信息Table 1 Basic information of coal |
| 煤样 | Mad /% | Aad /% | Vdaf /% | 煤阶 | 比表面积 /(m2/g) | 孔体积 /(cm3/g) |
|---|---|---|---|---|---|---|
| LS | 1.16 | 16.3 | 5.58 | 二号无烟煤 | 5.051 | 0.039 9 |
1.2 实验仪器
1.3 实验方法与步骤
1.3.1 等温吸附实验
1.3.2 吸附动力学实验
2 吸附动力学特征分析
2.1 煤样等温吸附实验分析
2.1.1 空白测试及浮力测试结果
表2 空白测试及浮力测试结果Table 2 Blank and buoyancy measurement result |
| 实验 编号 | 样品桶质量 (M sc)/g | 样品桶体积 (V sc)/cm3 | 试样质量 (M s)/g | 试样体积 (V s)/cm3 |
|---|---|---|---|---|
| LS-30 | 5.259 3 | 0.660 4 | 2.715 8 | 1.162 4 |
| LS-35 | 3.065 7 | 1.771 0 | ||
| LS-40 | 3.066 2 | 1.785 9 | ||
| S-45 | 2.891 3 | 1.301 9 |
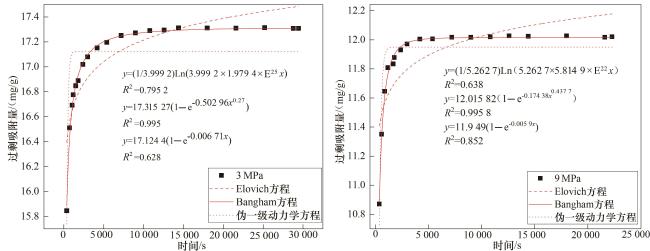
2.1.2 等温吸附曲线
2.2 煤样吸附动力学实验分析
2.2.1 吸附速度与平衡时间
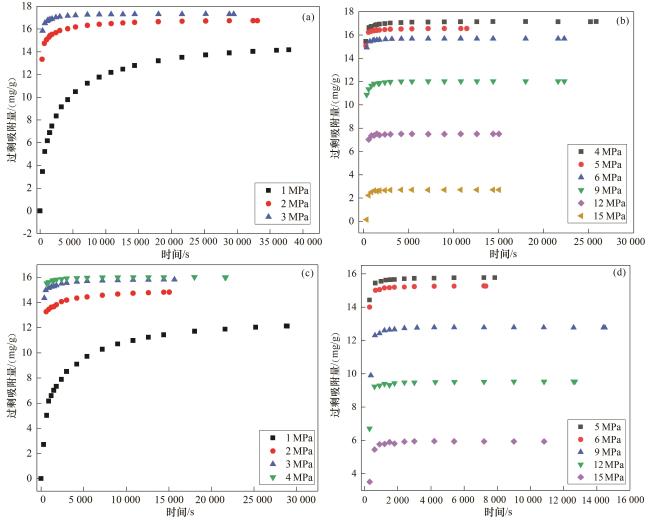
2.2.2 吸附动力学模型
图9 煤样Bangham动力学方程拟合结果Fig.9 Fitting result of Bangham kinetic equation of coal samples |
表3 Bangham动力学方程拟合常数Table 3 The fitting constants of Bangham kinetic equation |
| 煤样 | 压力 | 1 MPa | 2 MPa | 3 MPa | 4 MPa | 5 MPa | 6 MPa | 9 MPa | 12 MPa | 15 MPa |
|---|---|---|---|---|---|---|---|---|---|---|
| LS-30 | Q e | 14.460 | 16.781 | 17.315 | 17.026 | 16.468 | 15.635 | 11.950 | 7.520 | 2.756 |
| K b | 0.012 4 | 0.381 1 | 0.502 9 | 0.009 3 | 0.008 2 | 0.007 9 | 0.005 9 | 0.003 4 | 0.001 7 | |
| z | 0.543 | 0.255 | 0.270 | 1 | 1 | 1 | 1 | 1 | 0.7469 | |
| LS-45 | Q e | 12.254 | 14.971 | 15.837 | 15.978 | 15.728 | 15.234 | 12.726 | 9.467 | 5.915 |
| K b | 0.015 8 | 0.430 8 | 0.567 1 | 0.226 8 | 0.118 8 | 0.089 6 | 0.027 7 | 0.009 8 | 0.008 3 | |
| z | 0.538 | 0.242 | 0.247 | 0.412 | 0.533 | 0.584 | 1.499 | 1.5431 | 1.478 |


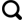







 甘公网安备 62010202000678号
甘公网安备 62010202000678号