0 引 言
1 实验装置及实验方法
1.1 实验装置
1.2 实验方法
2 实验结果及讨论
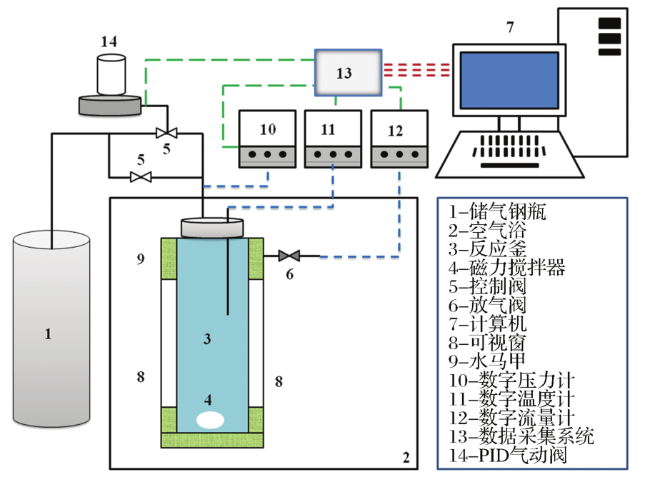
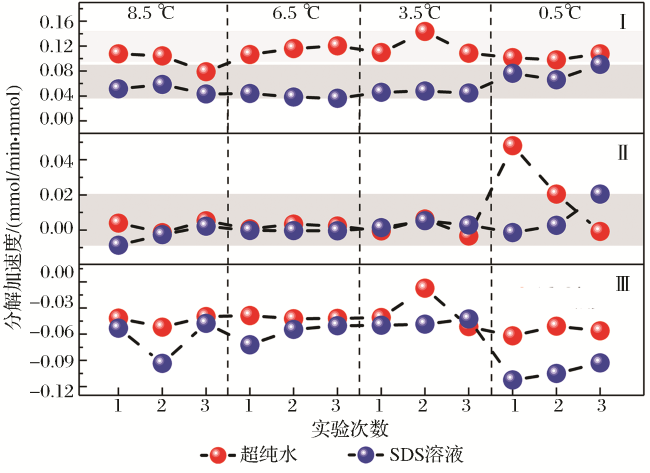
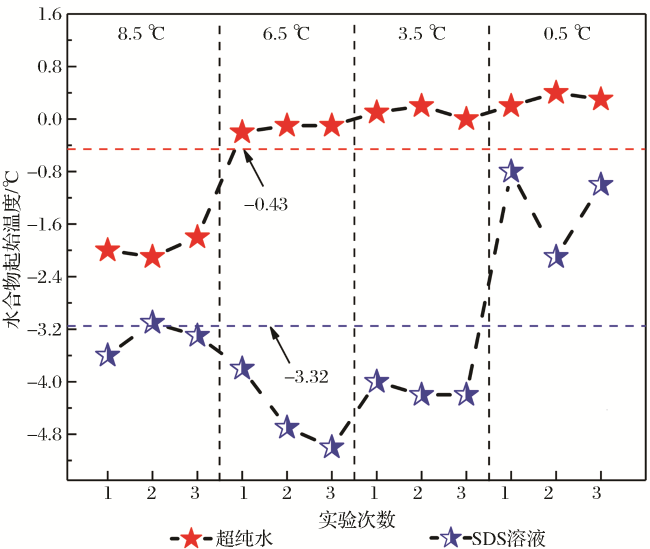
2.1 “自保护”效应下CO2水合物分解特征
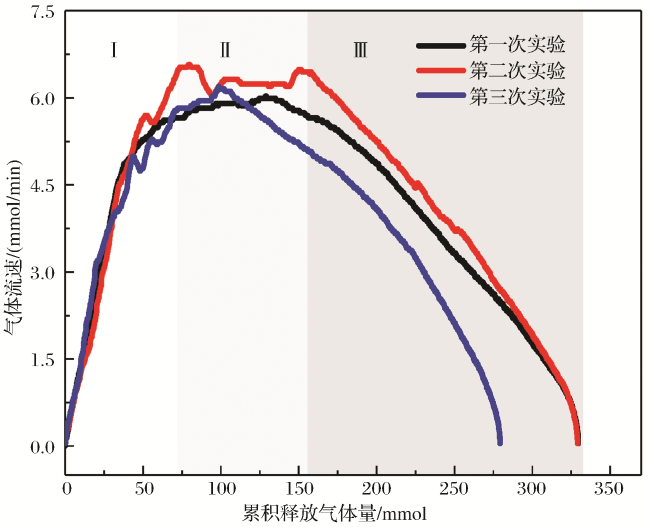
图4 6.5℃下生成的二氧化碳水合物“自保”条件下分解过程Fig.4 Decomposition process of carbon dioxide hydrate generated at 6.5 ℃ under ‘self-preservation’ condition |
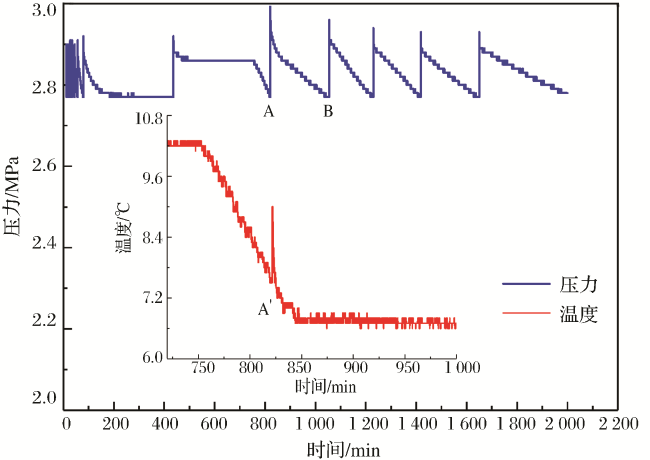
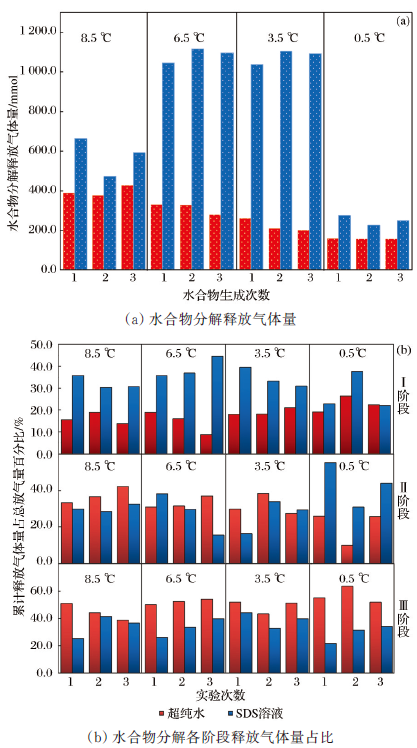
表1 水合物各生成阶段耗气量Table 1 Gas consumption during each hydrate formation stage |
| 反应介质 | 实 验 次 数 | 温度/℃ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 8.5 | 6.5 | 3.5 | 0.5 | |||||||||||
| 总耗气量 /mmol | 形成阶段 耗气量 /mmol | 冻结阶段耗气量 /mmol | 总耗气量 /mmol | 形成阶段耗气量 /mmol | 冻结阶段耗气量 /mmol | 总耗气量 /mmol | 形成阶段耗气量 /mmol | 冻结阶段耗气量 /mmol | 总耗气量 /mmol | 形成阶段耗气量 /mmol | 冻结阶段 耗气量 /mmol | |||
| 纯水 | 1 | 389.32 | 106.87 | 282.45 | 329.51 | 90.77 | 238.74 | 261.59 | 64.09 | 197.49 | 158.93 | 25.36 | 133.57 | |
| 2 | 376.88 | 97.31 | 279.58 | 329.01 | 90.44 | 238.57 | 209.97 | 28.72 | 181.25 | 158.52 | 22.48 | 136.03 | ||
| 3 | 428.88 | 122.55 | 306.32 | 279.26 | 55.56 | 223.71 | 201.48 | 27.62 | 173.87 | 157.64 | 19.97 | 137.67 | ||
| SDS溶液 | 1 | 663.30 | 147.50 | 515.80 | 1 046.09 | 535.35 | 510.74 | 1 038.06 | 607.08 | 430.98 | 275.52 | 57.03 | 218.49 | |
| 2 | 472.38 | 152.23 | 320.16 | 1 115.22 | 674.58 | 440.64 | 1 102.95 | 701.51 | 401.44 | 226.11 | 34.02 | 192.09 | ||
| 3 | 592.22 | 176.64 | 415.58 | 1 038.06 | 620.19 | 476.36 | 1 092.84 | 522.51 | 570.33 | 248.61 | 52.77 | 195.84 | ||


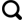
 甘公网安备 62010202000678号
甘公网安备 62010202000678号